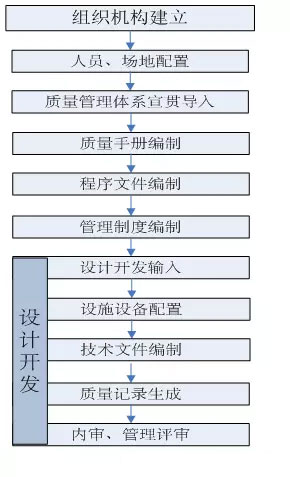

医疗器械GMP的目的是为了加强医疗器械生产监督管理,规范医疗器械生产质量管理体系,根据《医疗器械监督管理条例》和相关法规规定,自2011年1月1日起正式实行,2011年7月1日后达不到规范的企业将不允许注册。
GMP”是英文Good Manufacturing Practice 的缩写, Good 中文的意思是“良好作业规范 良好作业规范”,或是“优良制造 良好作业规范 优良制造 标准”,是一种特别注重在生产过程中实施保证产 品标准 质量安全的管理制度。
|
要点 |
常见误区 |
正确对策 |
|
体系建立时机 |
|
产品设计开发前 |
|
体系负责人 |
体系专员 |
最高管理者 |
|
体系参与人员 |
体系专员全责 |
全员参与 |
|
体系文件建立 |
简单套用他人模板 |
文件应适宜、完整、有效,与产品相适应,力求简洁 |
|
追溯性控制 |
部门之间追溯性信息未统一,质量记录无法满足追溯性要求 |
确保产品、原材料的批号、数量、日期等信息的一致性 |
|
法规依据 |
仅依据YY/T 0287-2003 |
GMP+YY/T 0287-2003 |
|
体系建立运行 |
由无体系运行经验的人员主导体系建立、运行 |
寻找有经验的辅导机构协助培训建立体系 |
|
序号 |
常见问题 |
后果 |
|
1 |
体系文件与产品特性、GMP要求不一致 |
体系无有效性,无法指导质量控制过程。 |
|
2 |
体系文件过于复杂,质量记录冗余度大 |
体系无适宜性,企业把大量时间用于质量记录的填写审核,体系认可度低。 |
|
3 |
过程结束后补记录 |
未在设计开发阶段就运行质量管理体系,导致在外部审核前补充过程记录,体系运行不充分。 |
|
4 |
产品、原材料名称、规格型号、批号、日期等信息不统一 |
因产品和原材料信息反复调整,导致产品追溯记录反复修改,体系无法快速运行。 |
|
5 |
人员未参与体系的实施过程 |
体系涉及的部门人员因工作较忙不能真正参与到体系的培训学习和运行过程,致体系无法有效运行,企业难以通过审核。 |
|
6 |
最高管理者不重视体系运行 |
无法得到体系运行需要的资源,各部门配合度低,体系难以运行。 |